सीबीएसई कक्षा 9 विज्ञान नोट्स अध्याय 3 परमाणु और अणु
परमाणु और अणु छोटे-छोटे रेत के कणों, विशाल ब्लैक होल और इनके बीच की हर चीज को बनाने के लिए जिम्मेदार हैं। परमाणु पदार्थ की सबसे मौलिक इकाई है, जिससे वह सब कुछ बनता है जो हम अपने चारों ओर देखते हैं। यह अत्यंत छोटा है, इसकी माप 0.1 से 0.5 नैनोमीटर से भी कम है।
परमाणुओं और अणुओं पर अध्याय सारांश के लिए, नीचे दिया गया वीडियो देखें
रासायनिक संयोजन के नियम
रासायनिक प्रतिक्रिएं
- एक रासायनिक प्रतिक्रिया में, दो या दो से अधिक अणु नए यौगिकों का उत्पादन करने के लिए परस्पर क्रिया करते हैं; उन्हें अभिकारक कहा जाता है, जबकि नवगठित यौगिकों को उत्पाद कहा जाता है।
- एक रासायनिक प्रतिक्रिया में, एक रासायनिक परिवर्तन अवश्य होता है, जो आम तौर पर वर्षा, गर्मी उत्पादन, रंग परिवर्तन आदि जैसे भौतिक परिवर्तनों के साथ देखा जाता है।
द्रव्यमान के संरक्षण का नियम
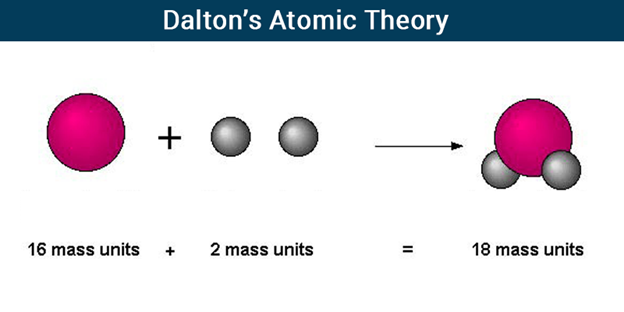
- द्रव्यमान संरक्षण के नियम के अनुसार, रासायनिक प्रतिक्रिया में पदार्थ को न तो बनाया जा सकता है और न ही नष्ट किया जा सकता है। यह संरक्षित रहता है.
- अभिकारकों का द्रव्यमान उत्पादों के द्रव्यमान के बराबर होगा।
स्थिर अनुपात का नियम
- एक शुद्ध रासायनिक यौगिक जिसमें समान तत्व द्रव्यमान द्वारा एक निश्चित अनुपात में एक साथ संयुक्त होते हैं, निश्चित अनुपात के नियम द्वारा दिया जाता है।
- उदाहरण के लिए, यदि हम किसी नदी या समुद्र से पानी लेते हैं, तो दोनों में ऑक्सीजन और हाइड्रोजन समान अनुपात में होते हैं।
रासायनिक यौगिकों में तत्व पूर्व निर्धारित द्रव्यमान अनुपात में मौजूद होते हैं। "स्थिर अनुपात का नियम" यह है। इस "निरंतर अनुपात का नियम" को "प्राउस्ट का नियम" या "परिभाषित अनुपात का नियम" के रूप में भी जाना जाता है। उदाहरण के लिए, शुद्ध पानी में ऑक्सीजन और हाइड्रोजन की मात्रा हमेशा 1:8 होती है।
परमाणुओं
परमाणु किसी तत्व की परिभाषित संरचना है, जिसे किसी भी रासायनिक माध्यम से नहीं तोड़ा जा सकता है।
परमाणु प्रतीक के तीन भाग होते हैं:-
- प्रतीक X: सामान्य तत्व प्रतीक
- परमाणु क्रमांक A: प्रोटॉन की संख्या के बराबर
- द्रव्यमान संख्या Z: किसी तत्व में प्रोटॉन और न्यूट्रॉन की कुल संख्या के बराबर।
परमाणु का आधा घेरा
किसी परमाणु के नाभिक और बाहरी इलेक्ट्रॉन आवरण के बीच की दूरी। परमाणु त्रिज्या की गणना एक साथ बंधे दो समान परमाणुओं के नाभिक के बीच की दूरी को मापकर की जाती है। इस दूरी का आधा भाग परमाणु त्रिज्या है।
डाल्टन का परमाणु सिद्धांत
डाल्टन के परमाणु सिद्धांत के अनुसार, परमाणु, जो अविनाशी और अविभाज्य निर्माण खंड हैं, सभी पदार्थों का निर्माण करते हैं। अन्य तत्वों के विपरीत, जिनमें विभिन्न आकार और वजन के परमाणु होते हैं, एक तत्व के सभी परमाणुओं का आकार और द्रव्यमान समान होता है।
डाल्टन ने प्रस्तावित किया कि परमाणुओं की अवधारणा का उपयोग द्रव्यमान और निश्चित अनुपात के संरक्षण के नियमों को समझाने के लिए किया जा सकता है। उन्होंने प्रस्तावित किया कि परमाणु, जिसे उन्होंने "ठोस, विशाल, कठोर, अभेद्य, गतिमान कण" के रूप में वर्णित किया है, पदार्थ की सबसे छोटी, अविभाज्य इकाइयाँ हैं।
- पदार्थ अविभाज्य कणों से बना है जिन्हें परमाणु कहा जाता है।
- किसी दिए गए तत्व के सभी परमाणुओं के गुण, द्रव्यमान सहित, समान होते हैं। इसे इस प्रकार भी कहा जा सकता है - किसी तत्व के सभी परमाणुओं का द्रव्यमान और रासायनिक गुण समान होते हैं; विभिन्न तत्वों के परमाणुओं का द्रव्यमान और रासायनिक गुण अलग-अलग होते हैं।
- विभिन्न तत्वों के परमाणु निश्चित अनुपात में मिलकर यौगिक बनाते हैं।
- परमाणु न तो बनते हैं और न ही नष्ट होते हैं। नए उत्पादों (यौगिकों) का निर्माण रासायनिक प्रतिक्रिया में मौजूदा परमाणुओं (अभिकारकों) के पुनर्व्यवस्था के परिणामस्वरूप होता है।
- किसी दिए गए यौगिक में परमाणुओं की सापेक्ष संख्या और प्रकार स्थिर होते हैं।
रासायनिक संयोजन के नियमों के बारे में अधिक जानने के लिए यहां जाएं ।
परमाणु भार
परमाणु द्रव्यमान और परमाणु द्रव्यमान इकाई
- परमाणु द्रव्यमान एक परमाणु में या परमाणुओं के समूह में इलेक्ट्रॉनों, न्यूट्रॉन और प्रोटॉन के द्रव्यमान का कुल औसत द्रव्यमान है।
- किसी परमाणु कण के द्रव्यमान को परमाणु द्रव्यमान कहा जाता है।
- इसे आम तौर पर एकीकृत परमाणु द्रव्यमान इकाई (एएमयू) के संदर्भ में अंतरराष्ट्रीय समझौते के अनुसार व्यक्त किया जाता है।
- इसे इसकी जमीनी अवस्था में कार्बन-12 परमाणु के द्रव्यमान के 1/12 के रूप में परिभाषित किया जा सकता है।
परमाणु द्रव्यमान के बारे में अधिक जानने के लिए यहां जाएं ।
मॉलिक्यूलर मास्स
किसी तत्व के आणविक द्रव्यमान को अणु में मौजूद तत्वों के द्रव्यमान के योग के रूप में परिभाषित किया जाता है।
- किसी तत्व के परमाणु द्रव्यमान को अणु में परमाणुओं की संख्या से गुणा करके और फिर अणु में सभी तत्वों के द्रव्यमान को जोड़कर आणविक द्रव्यमान प्राप्त किया जाता है।
आणविक द्रव्यमान के बारे में अधिक जानने के लिए, यहां जाएँ ।
अणु
सबसे छोटी पहचान योग्य इकाई जिसमें एक शुद्ध पदार्थ को उसकी संरचना और रासायनिक गुणों को बनाए रखते हुए विभाजित किया जा सकता है, एक अणु है, जो दो या दो से अधिक परमाणुओं का एक संग्रह है।
तत्वों के अणु
एक अणु दो या दो से अधिक रासायनिक रूप से बंधे परमाणुओं का एक संग्रह है, चाहे वे एक ही तत्व से हों या किसी अन्य से।
उदाहरण के लिए, जब दो हाइड्रोजन (H2 ) परमाणु और एक ऑक्सीजन (O2 ) परमाणु परस्पर क्रिया करते हैं, तो एक पानी का अणु बनता है।
यौगिकों के अणु
लवण और आणविक यौगिक दो श्रेणियां हैं जिनमें यौगिकों को विभाजित किया जा सकता है। सहसंयोजक बंधन आणविक अणुओं में परमाणुओं को एक साथ रखते हैं। आयनिक बंधन इसे लवणों में एक साथ रखते हैं। प्रत्येक यौगिक इन दो प्रकार के बंधों में से किसी एक से बना होता है।
दरअसल, यौगिक एक प्रकार का अणु होता है। पदार्थ को यौगिक के रूप में अर्हता प्राप्त करने के लिए एक साथ जुड़ने वाले परमाणुओं को एक दूसरे से अलग होना चाहिए। उदाहरण के लिए, O 2 एक अणु है, यौगिक नहीं, क्योंकि इसका परमाणु संबंध दूसरे ऑक्सीजन परमाणु से है। हालाँकि, NaCl एक यौगिक है क्योंकि यह दो अलग-अलग परमाणुओं से बना है जो रासायनिक रूप से एक साथ बंधे हैं।
तिल संकल्पना
मोल संकल्पना और अवोगाद्रो संख्या
- किसी पदार्थ में विद्यमान संस्थाओं की मात्रा। उदाहरण के लिए परमाणुओं, अणुओं और आयनों को एक मोल के रूप में परिभाषित किया गया है। किसी भी पदार्थ का एक मोल 6.022×10 23 अणुओं का होता है।
- मोल अवधारणा प्रतिक्रिया में अभिकारकों और उत्पादों की मात्रा को व्यक्त करने के सबसे सुविधाजनक तरीकों में से एक है।
अवोगाद्रो संख्या का मान लगभग 6.022×10 23 है । एवोगैड्रो संख्या की परिभाषा यह है कि यह हमें किसी पदार्थ के 1 मोल (या मोल) में कणों की संख्या बताती है। ये कण इलेक्ट्रॉन या अणु या परमाणु हो सकते हैं।
मोल कॉन्सेप्ट के बारे में अधिक जानने के लिए यहां जाएं ।
दाढ़ जन
दाढ़ जन
पदार्थ वह वस्तु है जिसका द्रव्यमान होता है और वह स्थान घेरता है। मोलर द्रव्यमान/आणविक भार वास्तव में प्रति मोल एक अणु बनाने के लिए मौजूद परमाणुओं के ग्राम में कुल द्रव्यमान का योग है। दाढ़ द्रव्यमान की इकाई ग्राम/मोल है।
मोलर मास के बारे में अधिक जानने के लिए यहां जाएं ।
परमाणु संयोजकता
अणु और परमाणुता
अणु को किसी यौगिक की सबसे छोटी इकाई के रूप में परिभाषित किया जाता है जिसमें यौगिक के रासायनिक गुण होते हैं।
- किसी तत्व की परमाणुता उस तत्व के एक अणु में परमाणुओं की संख्या है।
- उदाहरण के लिए, हाइड्रोजन, नाइट्रोजन, ऑक्सीजन, क्लोरीन, आयोडीन और ब्रोमीन सभी के प्रत्येक अणु में दो परमाणु होते हैं। तो, हाइड्रोजन, नाइट्रोजन, ऑक्सीजन, क्लोरीन, आयोडीन और ब्रोमीन की परमाणुता प्रत्येक दो है।
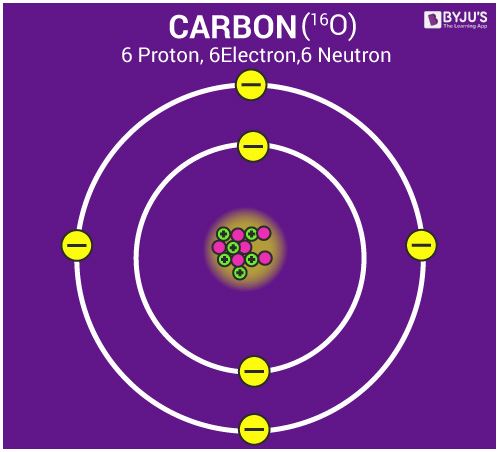
एक परमाणु की संरचना
- परमाणु तीन कणों से बना है; इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन।
- परमाणु के केंद्र को नाभिक कहा जाता है। एक परमाणु के नाभिक में एक परमाणु का पूरा द्रव्यमान होता है।
- किसी परमाणु में इलेक्ट्रॉन कोश/कक्षकों में व्यवस्थित होते हैं।
संयोजकता
वैलेंस इलेक्ट्रॉन वे इलेक्ट्रॉन होते हैं जो परमाणु की सबसे बाहरी कक्षा में मौजूद होते हैं।
- किसी परमाणु की अपने अष्टक को पूरा करने के लिए वैलेंस इलेक्ट्रॉनों को खोने, प्राप्त करने या साझा करने की क्षमता परमाणु की वैलेंस निर्धारित करती है।
वैलेंसी के बारे में अधिक जानने के लिए यहां जाएं ।
रासायनिक सूत्र लिखना
यौगिकों
- जब दो या दो से अधिक तत्व द्रव्यमान द्वारा एक निश्चित अनुपात में रासायनिक रूप से संयोजित होते हैं, तो प्राप्त उत्पाद को यौगिक के रूप में जाना जाता है।
- यौगिक वे पदार्थ होते हैं जिनमें दो या दो से अधिक विभिन्न प्रकार के तत्व अपने परमाणुओं के एक निश्चित अनुपात में होते हैं।
आयनों
- एक आयन को एक परमाणु या अणु के रूप में परिभाषित किया जाता है जिसने अपने एक या अधिक वैलेंस इलेक्ट्रॉनों को प्राप्त या खो दिया है, जिससे इसे शुद्ध सकारात्मक या नकारात्मक चार्ज मिलता है।
- ऋणात्मक रूप से आवेशित कण को आयन कहा जाता है, और धनात्मक रूप से आवेशित कण को धनायन कहा जाता है।
आयनिक यौगिक: रासायनिक सूत्र
रासायनिक सूत्र में प्रत्येक घटक तत्व की पहचान उसके रासायनिक प्रतीक के साथ-साथ प्रत्येक तत्व को बनाने वाले परमाणुओं की सापेक्ष संख्या से की जाती है। इन अनुपातों का उपयोग अनुभवजन्य समीकरणों में एक प्रमुख तत्व से शुरू करने के लिए किया जाता है और फिर मुख्य तत्व के संबंध में यौगिक में शेष तत्वों के लिए परमाणु गणना निर्दिष्ट की जाती है।
- आयनिक यौगिक रासायनिक यौगिक होते हैं जिनमें आयन विशेष बंधों द्वारा एक साथ बंधे रहते हैं जिन्हें आयनिक बंध कहते हैं।
- एक आयनिक यौगिक में हमेशा समान मात्रा में धनात्मक और ऋणात्मक आवेश होता है।
- उदाहरण के लिए: कैल्शियम क्लोराइड में, आयनिक बंधन विपरीत रूप से चार्ज किए गए कैल्शियम और क्लोराइड आयनों द्वारा बनता है।
कैल्शियम परमाणु 2 इलेक्ट्रॉन खो देता है और निकटतम उत्कृष्ट गैस (Ar) का इलेक्ट्रॉनिक विन्यास प्राप्त कर लेता है। ऐसा करने पर, उसे +2 का शुद्ध आवेश प्राप्त होता है।
दो क्लोरीन परमाणु एक-एक इलेक्ट्रॉन लेते हैं, इस प्रकार -1 (प्रत्येक) का चार्ज प्राप्त करते हैं और निकटतम उत्कृष्ट गैस (Ar) का इलेक्ट्रॉनिक विन्यास प्राप्त करते हैं।
रासायनिक सूत्र लिखने के बारे में अधिक जानने के लिए, यहां जाएँ ।
BYJU'S पर पंजीकरण करके परमाणुओं और अणुओं पर कक्षा 9 के नोट्स पर अधिक प्रश्न, अवधारणाएं और युक्तियां खोजें।
अग्रिम पठन:-
और पढ़ें:
- कक्षा 9 विज्ञान अध्याय 3-परमाणु और अणु के लिए महत्वपूर्ण प्रश्न
- कक्षा 9 के लिए गणित के नोट्स
- सीबीएसई कक्षा 9 सामाजिक विज्ञान नोट्स
सीबीएसई कक्षा 9 विज्ञान नोट्स अध्याय 3 परमाणु और अणु पर अक्सर पूछे जाने वाले प्रश्न
परमाणुओं और अणुओं में क्या अंतर है?
परमाणु किसी रासायनिक तत्व की सबसे बुनियादी या सबसे छोटी इकाई को संदर्भित करते हैं। इसकी तुलना में, अणु 2 या अधिक परमाणुओं से मिलकर बने होते हैं।
डाल्टन कौन थे?
जॉन डाल्टन एक अंग्रेजी रसायनज्ञ और भौतिक विज्ञानी थे, और वह अपने परमाणु सिद्धांत के लिए जाने जाते थे।
तिल क्या है?
मोल किसी भी पदार्थ की मात्रा मापने की एक मानक इकाई है।
| सीबीएसई संबंधित लिंक |





